酸碱指示剂变色原理 酸碱指示剂的作用原理和变色原理是一样的吗
2020-05-22 20:36:35
来源:朵拉利品网
1, 酸碱指示剂的作用原理和变色原理是一样的吗
酸碱指示剂是一类在其特定的pH值范围内,随溶液pH值改变而变色的化合物,通常是有机弱酸或有机弱碱。当溶液pH值发生变化时,指示剂可能失去质子由酸色成分变为碱色成分,也可能得到质子由碱色成分变为酸色成分;在转变过程中,由于指示剂本身结构的改变,从而引起溶液颜色的变化。指示剂的酸色成分或碱色成分是一对共轭酸碱。指示剂的变色原理现以弱酸型指示剂(如酚酞)为例,说明酸碱指示剂的变色 原理。弱酸型酸碱指示剂在溶液中存在下列平衡:[H+]=KHIn*[HIn]/[In-]HIn表示弱酸的分子,为酸色成分;In-是弱酸分子离解出H+以后的复杂离子,为碱色成分。酚酞的酸色成分是无色的,碱色的成分则呈红色。根据平衡原理:[H+]=KHIn*[HIn]/[In]将等式两边各取负对数得:pH=pKHIn+p[HIn]/[In]已知溶液的颜色决定于碱色成分的浓度比值,而此比值又与pH和pKHIn值有关。一定温度下,对指定的某种指示剂,pKHIn是一常数。所以碱色成分与酸色成的浓度比值随溶液pH值的改变而变化,溶液的颜色也随之改变。例如,在酚酞指示剂溶液中加入酸时,H+就大量增多,使酚酞的离解平衡向左移动,这时酸色成分增多,碱色成分减少,溶液的颜色以酸色为主,酚酞在酸液中是无色的。反之,如向溶液中加碱时,则平衡向右移动,碱色成分增加,酸色成分减少,溶液的颜色就以碱色为主,酚酞在碱液中是红色的。所以指示剂可用以指示溶液的酸碱性或测定溶液的ph值。上述弱酸指示剂的变色原理,同样适用于弱碱指示剂。
2, 指示剂的变色原理是什么????急

酸碱指示剂有一大部分是有机弱酸。它们在溶液中能部分电离成指示剂的离子和氢离子(或氢氧根离子),并且由于结构上的变化,它们的分子和离子具有不同的颜色,因而在pH不同的溶液中呈现不同的颜色。常用的酸碱指示剂主要有以下四类:1 硝基酚类 这是一类酸性显著的指示剂,如对-硝基酚等。2 酚酞类 有酚酞、百里酚酞和α-萘酚酞等,它们都是有机弱酸。3 磺代酚酞类 有酚红、甲酚红、溴酚蓝、百里酚蓝等,它们都是有机弱酸。4 偶氮化合物类 有甲基橙、中性红等,它们都是两性指示剂,既可作酸式离解,也可作碱式离解
3, 酸碱指示剂的变色范围是多少?
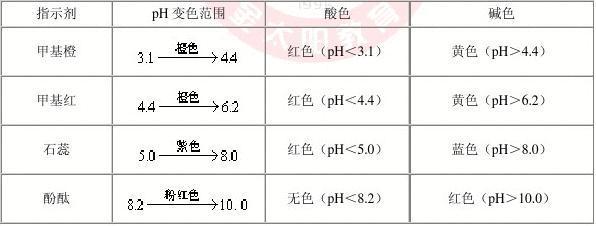
①酸碱指示剂。指示溶液中H+浓度的变化,是一种有机弱酸或有机弱碱,其酸性和碱性具有不同的颜色。指示剂酸HIn在溶液中的离解常数Ka=[H+][In-]/[HIn],即溶液的颜色决定于[In-]/[HIn],而[In-]/[HIn]又决定于[H+]。以甲基橙(Ka=10-3.4)为例,溶液的pH4.4时,呈碱性,具黄色;而在pH3.1~4.4,则出现红黄的混合色橙色,称之为指示剂的变色范围。不同的酸碱指示剂有不同的变色范围。②金属指示剂。络合滴定法所用的指示剂,大多是染料,它在一定pH下能与金属离子络合呈现一种与游离指示剂完全不同的颜色而指示终点。③氧化还原指示剂。为氧化剂或还原剂,它的氧化形与还原形具有不同的颜色 ,在滴定中被氧化(或还原)时,即变色,指示出溶液电位的变化。④沉淀滴定指示剂。主要是Ag+与卤素离子的滴定,以铬酸钾、铁铵矾或荧光黄作指示剂
名词解释
指示剂
指示剂是分析化学中的一类试剂,它用于滴定操作中,用来指示滴定反应的终点。滴定反应需要灵敏的指示剂来指示反应的完成。指示剂在反应完成时,会迅速变成另一种颜色。这样实验者就可以根据指示剂的变色来确定反应的终止。
溶液
溶液是由至少两种物质组成的均一、稳定的混合物,被分散的物质( 溶质)以分子或更小的质点分散于另一物质(溶剂)中。物质在 常温时有固体、液体和气体三种 状态。因此溶液也有三种状态,大气本身就是一种气体溶液, 固体溶液混合物常称固溶体,如合金。一般溶液只是专指液体溶液。液体溶液包括两种,即能够导电的 电解质溶液和不能导电的 非电解质溶液。所谓胶体溶液,更确切的说应称为 溶胶。其中,溶质相当于 分散质,溶剂相当于分散剂。在生活中常见的溶液有蔗糖溶液、碘酒、澄清石灰水、稀盐酸、盐水、空气等。
相关资讯
最新资讯
相关企业
