二类医疗器械注册流程 二类医疗器械的注册流程是怎样的?
2020-04-26 18:20:07
来源:朵拉利品网
1, 二类医疗器械的注册流程是怎样的?
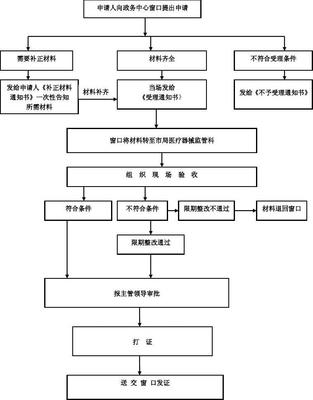
一、经营第二类医疗器械不需要办理经营许可证,只需要办理备案凭证即可。二、办理的具体流程:(一)、首先到工商局办理营业执照,注册为企业,可以是法人企业、非法人企业、个人独资企业、合伙制企业等,个体工商户不可以办理备案凭证。(二)、然后到质监局办理组织机构代码证。(三)、最后到国 家食品药品监督管理总局网站用组织机构代码注册 一个帐号,网上申报。(四)、网上申报《医疗器械备案申请表》需要提交的电子材料,其中加*为必需项。1.*营业执照和组织机构代码证复印件2. *法定代表人、企业负责人、质量负责人的身份证明、学历或者职称证明复印件3. *组织机构与部门设置说明4. *经营范围、经营方式说明5. *经营场所、库房地址的地理位置图、平面图、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件6.*经营设施、设备目录7. *经营质量管理制度、工作程序等文件目录8. 计算机信息管理系统基本情况介绍和功能说明9. *经办人授权证明10. *签字并加盖公章的申请表扫描版三、第二类医疗器械办理备案,审批部门是设区的市一级药监局,网上申报受理后企业按要求提供纸质材料到政务大厅申报,经现场验收合格后,发备案凭证后您就可以经营了。
2, 二类医疗器械注册流程?
企业向所在地省、自治区、直辖市(食品)药品监督管理部门提出申请,填写《医疗器械生产企业许可证(开办)申请表》,并提交以下材料:1、法定代表人、企业负责人的基本情况及资质证明;2、工商行政管理部门出具的拟办企业名称预先核准通知书;3、企业生产、质量和技术负责人的简历、学历或者职称证书;相关专业技术人员、技术工人登记表,并标明所在部门和岗位;高级、中级、初级技术人员的比例情况表;4、拟生产产品范围、品种和相关产品简介;生产场地证明文件5、主要生产设备和检验设备目录;6、拟生产产品的工艺流程图,并注明主要控制项目和控制点;7、生产无菌医疗器械的,应当提供生产环境检测报告。流程:1、申请事项依法不属于本部门职权范围的,应当即时作出不予受理的决定,并告知申请人向有关行政机关申请;2、申请材料存在可以当场更正的错误的,应当允许申请人当场更正;3、申请材料不齐全或者不符合形式审查要求的,应当当场或者在5个工作日内发给申请人《补正材料通知书》,一次性告知申请人需要补正的全部内容,逾期不告知的,自收到申请材料之日起即为受理;4、申请材料齐全、符合形式审查要求的,或者申请人按照要求提交全部补正申请材料的,予以受理。5、省、自治区、直辖市(食品)药品监督管理部门受理或者不予受理医疗器械生产企业开办申请的,应当出具加盖本部门受理专用印章并注明日期的《受理通知书》或者《不予受理通知书》。6、经审查符合规定的,作出准予发证的书面决定,并于10个工作日内发给《医疗器械生产企业许可证》。经审查不符合规定的,作出不予发证的书面决定,并说明理由。注意事项:1、已注册的第二类、第三类医疗器械,医疗器械注册证及其附件载明的内容发生变化,申请人应当向原注册部门申请注册变更,并按照相关要求提交申报资料。2、已备案的医疗器械,管理类别调整为第二类或者第三类医疗器械的,备案人应当主动向相应的食品药品监督管理部门提出取消原备案。3、未依法办理第二类、第三类医疗器械注册登记事项变更销售、使用的,由县级以上食品药品监督管理部门责令限期改正。参考资料来源:百度百科-二类医疗器械
3, 二类医疗器械注册要怎么搞?

一、申请与受理:登陆北京市药品监督管理局企业服务平台进行网上申报,根据受理范围的规定,需提交申请材料去申请。二、技术审评:审评分为审查、核准。三、审核:确定审批过程应符合《医疗器械注册管理办法》和相关注册工作程序的规定和确定技术审评结论是否明确。四、复审:医疗器械处主管处长对审核人员出具的审核意见进行审查以及确定审批过程符合国家有关审批程序和相关注册工作程序的规定。五、审定:市药品监督局主管局长对复审人员出具的复审意见进行审定。六、行政许可决定:医疗器械处审核人员对准予许可的,制作《中华人民共和国医疗器械注册证》,同时制作《医疗器械注册登记表》,加盖市药品监督管理局医疗器械注册专用章。七、送达:市药品监督局受理办送达窗口人员负责通知申请人携带《受理通知书》领取《中华人民共和国医疗器械注册证》或《不予行政许可决定书》,在《送达回执》上签字,注明日期, 加盖北京市药品监督管理局行政许可专用章。 奥咨达医疗器械咨询有限公司(广州、北京、上海、苏州、深圳、济南、美国)是国内唯一专注于医疗器械领域的医疗器械法规咨询企业。你可以找它来咨询一下。
4, 二类医疗器械怎么办理?什么流程?

按照现在工商局规定,医疗器械经营属于后置许可,应先办理工商执照,再办理医疗器械经营许可。工商注册流程就不多说了。办理医疗器械经营许可应该提交的资料:(一)营业执照和组织机构代码证复印件;(二)法定代表人、企业负责人、质量负责人的身份证明、学历或者职称证明复印件;(三)组织机构与部门设置说明;(四)经营范围、经营方式说明; (五)经营场所、库房地址的地理位置图、平面图、房屋产权证明文件或者租赁协议(附房屋产权证明文件)复印件;(六)经营设施、设备目录;(七)经营质量管理制度、工作程序等文件目录;(八)计算机信息管理系统基本情况介绍和功能说明;(九)经办人授权证明;(十)其他证明材料。第十二条 从事第二类医疗器械经营的,经营企业应当向所在地设区的市级食品药品监督管理部门备案,填写第二类医疗器械经营备案表,并提交本办法第八条规定的资料(第八项除外)。如果能帮到你,可以追问我。
名词解释
医疗器械
医疗器械是指直接或者间接用于人体的仪器、设备、器具、体外诊断试剂及校准物、材料以及其他类似或者相关的物品,包括所需要的计算机软件;其效用主要通过物理等方式获得,不是通过药理学、免疫学或者代谢的方式获得,或者虽然有这些方式参与但是只起辅助作用;其目的是疾病的诊断、预防、监护、治疗或者缓解;损伤的诊断、监护、治疗、缓解或者功能补偿;生理结构或者生理过程的检验、替代、调节或者支持;生命的支持或者维持;妊娠控制;通过对来自人体的样本进行检查,为医疗或者诊断目的提供信息。
申请人
申请人(Petitioner)是指提起诉讼的一方当事人,也可称为原告(Plaintiff)。申请人(Petitioner)通常适用于某些州的特定案件中,如离婚以及其它家庭法案件。
相关资讯
最新资讯
相关企业
