cvd化学反应类型 化学反应类型
2019-08-23 04:23:09
来源:朵拉利品网
1, 化学反应类型

定义:在化学反应中,分子破裂成原子,原子重新排列组合生成新物质的过程,称为化学反应。实质:是旧化学键断裂和新化学键形成的过程。在反应中常伴有发光、发热、变色、生成沉淀物等.判断一个反应是否为化学反应的依据是反应是否生成新的物质。根据化学键理论,又可根据一个变化过程中是否有旧键的断裂和新键的生成来判断其是否为化学反应。有五种主要化学反应如下所示:异构化:(A → B) :化合物形成结构重组而不改变化学组成物。 化学合成:化合反应简记为:A + B = C:二种以上元素或化合物合成一个复杂产物。(即由两种或两种以上的物质生成一种新物质的反应。)化学分解:分解反应简记为:A = B + C :化合物分解为构成元素或小分子。 (即化合反应的逆反应。它是指一种化合物在特定条件下分解成两种或两种以上较简单的单质或化合物的反应。)置换反应(单取代反应) 简记为:A+BC=B+AC :表示额外的反应元素取代化合物中的一个元素。(即指一种单质和一种化合物生成另一种单质和另一种化合物的反应。)(置换关系是指组成化合物的某种元素被组成单质的元素所替代。置换反应必为氧化还原反应,但氧化还原反应不一定为置换反应。)根据反应物和生成物中单质的类别,置换反应有以下4种情况:①较活泼的金属置换出较不活泼的金属或氢气②较活泼的非金属置换出较不活泼的非金属③非金属置换出金属④金属置换出非金属(详细请见置换反应词条……)复分解反应(双取代反应)简记为:AB+CD=AD+CB :在水溶液中(又称离子化的)两个化合物交换元素或离子形成不同的化合物。(即由两种化合物互相交换成分,生成另外两种化合物的反应。) 复分解反应的本质是溶液中的离子结合成难电离的物质(如水)、难溶的物质或挥发性气体,而使复分解反应趋于完成。酸、碱、盐溶液间发生的反应一般是两种化合物相互交换成分而形成的,即参加反应的化合物在水溶液中发生电离离解成自由移动的离子,离子间重新组合成新的化合物,因此酸、碱、盐溶液间的反应一般是复分解反应。复分解反应是离子或者离子团的重新组合,因为此类反应前后各元素的化合价都没有变化,所以复分解反应都不是氧化还原反应。当然还有更多复杂的情形,但仍可逐步简单化而视为上述反应类别的连续反应。 化学反应的变化多端难以建立简单的分类标准。 但是一些类似的化学反应仍然可以归类,譬如:歧化反应 :指的是同一物质的分子中同一价态的同一元素间发生的氧化还原反应。同一价态的元素在发生氧化还原反应过程中发生了“化合价变化上的分歧”,有些升高,有些降低。发生歧化反应的元素必须具有相应的高价态和低价态化合物,歧化反应只发生在中间价态的元素上。氟(F2)无歧化作用,因为氟元素电负性最大,无正化合价,只有负化合价。 自身氧化还原反应与歧化反应均属同种物质间发生的氧化还原反应,歧化反应是自身氧化还原反应的一种,但自身氧化还原反应却不一定都是歧化反应。 归中反应(反歧化反应):指的是物质中不同价态的同种元素之间发生的氧化还原反应。即同一元素的价态由反应前的高价和低价都转化成反应以后的中间价态,在化学反应中元素的价态变化有个规律:只靠拢,不交叉。因此元素的高价和低价都只能向中间靠拢。归中反应和歧化反应是两个‘相反’的过程,这两种反应都一定是氧化还原反应。有机反应:指以碳原子化合物为主的各种反应。 氧化还原反应:指两化合物间的电子转移(如:单取代反应和燃烧反应) 燃烧反应(初中化学书上也叫氧化反应):指受质和氧气的反应。 更多的例子参见化学反应列表(list of reactions)。
2, 基本化学反应类型是什么?

初中阶段所学的基本反应类型包括:化合反应、分解反应、置换反应和复分解反应化合反应:两种或者两种以上的物质生成一种物质的反应,称为化合反应;化合反应的字母关系式可表示为:A+B→C。如:CaO+H2O=Ca(OH)2分解反应:一种物质分解成两种或者两种以上物质的反应,称为分解反应;分解反应的字母关系式可表示为:A→B+C。如:H2CO3=H2O+CO2置换反应:一种单质和一种化合物反应,生成另一种单质和另一种化合物,字母表示为:A+BC→B+AC。如:Fe+2HCl=FeCl2+H2↑;CuO+H2=Cu+H2O(此反应需要加热条件,由于在横线上打不上加热符号,故略);置换反应必定有元素的化合价升高和降低,所以一定是氧化-还原反应。复分解反应:一种化合物和另一种化合物反应,互相交换成分的反应类型,字母表示为:AB+CD=AD+CB;如:CuSO4+BaCl2=CuCl2+BaSO4↓;Na2CO3+2HCl=NaCl+CO2↑+H2O;复分解反应发生需要一定的条件,即参加反应的物质中至少一种可溶于水,生成物至少要有沉淀或者气体或者水;酸碱中和反应属于复分解反应。
3, 高中化学反应类型

主要反应类型:1:无机反应:分解反应(指一种化合物在特定条件下分解成二种或二种以上较简单的单质或化合物的反应)化合反应(指的是由两种或两种以上的物质生成一种新物质的反应)复分解反应(由两种化合物互相交换成分,生成另外两种化合物的反应)置换反应(指一种单质和一种化合物生成另一种单质和另一种化合物的反应)2:有机反应:加成反应(加成反应进行后,重键打开,原来重键两端的原子各连接上一个新的基团)消去反应(有机化合物在适当的条件下,从一个分子脱去一个小分子(如水、卤化氢等分子),而生成不饱和(双键或三键)化合物的反应)取代反应(有机化合物受到某类试剂的进攻,使分子中一个基(或原子)被这个试剂所取代的反应)加聚反应(单体间相互反应生成一种高分子化合物,叫做加聚反应)缩聚反应(两个或多个有机分子相互作用后以共价键结合成一个大分子,同时失去水或其他比较简单的无机或有机分子的反应)3:氧化还原反应(氧化还原反应是在反应前后,某种元素的化合价有变化的化学反应)4:离子反应(有离子参加的化学反应)5:自发反应,非自发反应6:放热反应,吸热反应7:可逆反应,不可逆反应8:异构反应(氧气变臭氧,臭氧变氧气)注意:以上是主要反应类型,要具体分还有很多.比如中和反应其实就是复分解反应,也属于放热反应,也是自发反应.又比如酯化反应,其实是取代反应.还有硫化,硝化,水解,燃烧,脱水,亲电反应,亲核反应;硝化反应,卤化反应,磺化反应,氨化反应,酰化反应,氰化反应等等等等...只要记住基本反应类型就行了,其它只须了解.还有一点:核反应不是化学反应.
4, 高中化学反应类型一共有几种?
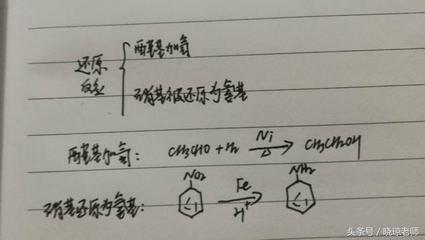
有机: 取代反应 :分子里某些原子或原子团被其它原子或原子团所替代的反应 加成反应 :有机分子里不饱和的碳原子与其它原子或原子团直接结合生成新的化合物的反应。 消去反应 :有机物从分子里脱去小分子而成为不饱和分子。 酯化反应 :酸和醇反应生成酯和水的反应 水解反应 :有机物和水作用生成两个或几个产物的反应 氧化反应 :有机物燃烧或得氧失氢的反应 还原反应 :失氧得氢的反应。(加氢反应为还原反应) 加聚反应 :由不饱和的单体聚合生成高分子化合物的反应。 缩聚反应 :由单体相互反应成高分子化合物同时还生成小分子。 裂化反应 :在一定条件下,把相对分子质量大,沸点高的长链烃断裂为相对分子质量小,沸点低的短链烃的反应。 无机: 化学反应可以分类为四种基本反应类型:化合反应、分解反应、置换反应和复分解反应。 化合反应:由两种或两种以上的物质生成另一种物质的反应,叫做化合反应。 A+B=C 分解反应:由一种物质生成两种或两种以上的其它物质的化学反应,叫做分解反应。 A=B+C 置换反应:一种单质与另一种化合物起反应生成另一种单质和化合物的反应叫置换反应。 A+BC=AC +B 复分解反应:两种化合物相互交换离子生成另外两种化合物的反应叫复分解反应。 AB+CD=AD +CB 最后当然也有什么都不是的 比如说氧气变臭氧 化合价没变 想到什么我再来补充
相关概念
反应
反应,汉语词语,一般指代因为事件所引发的回应,也指物质受作用而引起变化的现象、过程或一种化学变化。
相关资讯
相关产品
- 36V48V转5V电源转换器降压模块DC-DC车载降压模块10A 质量优廉
- 【DEVICENET电缆】DEVICENET电缆价格_DEVICENET电缆批发
- 供应原装Delta/台达变频器VFD550C43A 55KW VFD-C2000通用型
- VR电动影院 9DVR双人蛋椅 VR设备,9DVR虚拟现实体验平台OWATCH
- EVICOM GD1/538 PVC
- EVICOM GD1/881 PVC
- 直流DC650V转交流380V三相工频逆变器1000W
- 直流DC450V转交流380V三相工频逆变器4000W
- 智能语音 mp3控制器、市电输入电压:AC220V、110V、DC12、24V
- dn600 upuvc双壁波纹管 600 pvc排水管价格 upvc管价格 pv...
最新资讯
相关企业
